Валсартан: предполагаем индуктор на кожен меланом?
Валсартан е широко използван медикамент за лечение на артериална хипертония. За съжаление през юни тази година, американският производител Prinston Pharmaceuticals Inc. информира Центъра за оценка и изследване на лекарствата на FDA (Food and Drug Administration), че спира производството на продукти, съдържащи валсартан, защото открива следи от N-nitrosodimethylamine (NDMA) в активната фармацевтичната съставка на валсартан (API), предоставен от китайския производител Zhejiang Huahai Pharmaceutical Co. Въпреки, че количествата на NDMA Prinston са били малки, FDA счита, че те са неприемливи, тъй като NDMA се класифицира като химично вещество, което принадлежи към семейството на мощни канцерогени. Използва се за производство на ракетно гориво, омекотители, и други продукти. Освен това може да бъде и произведен чрез определени химични реакции и е страничен продукт от производството на някои пестициди, производството на гуми или преработка на риба. Проучвания с животни показват, че NDMA може да бъде токсичен и да причини тумори в черния дроб, бъбреците и дихателните пътища, което го прави потенциално вреден за хората в определени количества. Според US Department of Health and Human Services излагането на високи дози може да причини увреждане на черния дроб и NDMA е вероятен човешки канцероген.
През август 2018г., европейските и американските здравни служби разширяват оттеглянето на валсартан след откриване на N-нитрозодиметиламин (NDMA) в лекарства, произвеждани от втори китайски фармацевтичен производител- Zhejiang Tianyu Pharmaceuticals of Taizhou и от производител в Индия- Hetero Labs Limited, наречен Camber Pharmaceuticals.
Независимо, че валсартан се използва като компонент на други генерични лекарства, FDA обявява, че не всички лекарства съдържащи съставката са потенциално опасни и American Heart Association съветва пациентите да не прекратяват приема на лекарства без разрешение от лекар. Въпреки това няколко компании доброволно изтеглят свои продукти с валсартан, а именно валсартан от Major Pharmaceuticals, Solco Healthcare и Teva Pharmaceuticals Industries, както и valsartan/hydrochlorothiazide от Solco and Teva.
Междувременно Dr. Gregory Prokopowicz, Director of the Johns Hopkins Hypertension Center and Assistant Professor of Medicine at the Johns Hopkins University School of Medicine отбелязва, че медикаменти, които са комбинация от валсартан с амлодипин или сакубитрил, на компанията Novartis, не принадлежат към изтеглените продукти. Изявлението на Eric Althoff, от името на Novartis (която в Европа и Азия е оригиналния производител на валсартан) е, че никакви продукти на Novartis или Sandoz в САЩ, нито продукти на Novartis Pharma, съдържащи валсартан, не са засегнати от изтеглянето, тъй като валсартан API (активна фармацевтична съставка) в тези продукти не идва от същия източник както на продуктите, засегнати извън Съединените Американкси щати.
Проучването на FDA, обаче показва обратното- неочаквано е открито наличието на NDMA и се смята, че то е свързано с промени в начина, по който активното вещество е произведено. Отговорът, който последва от Althoff е, че не може да се каже със сигурност как тази съставка потенцира канцерогенния риск при хората и, че количеството NMDA намерено във валсартан API не представлява риск за пациентите.
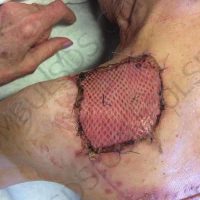
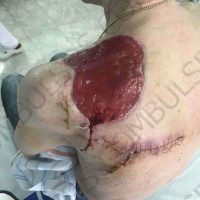
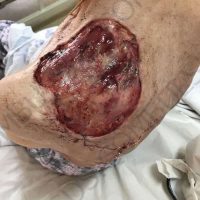
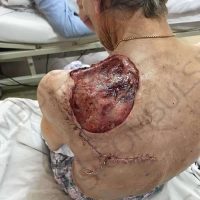
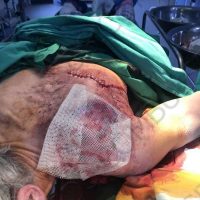
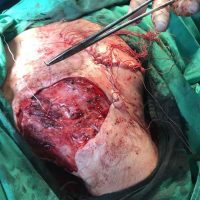
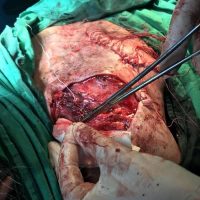
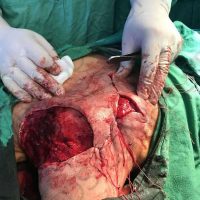
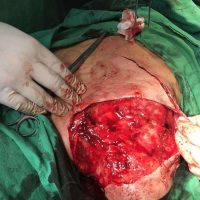
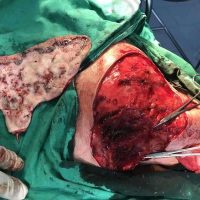
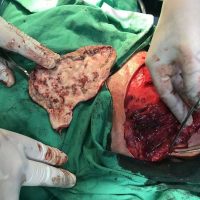
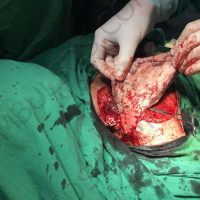
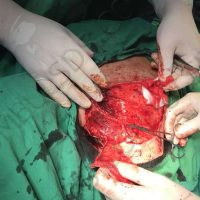
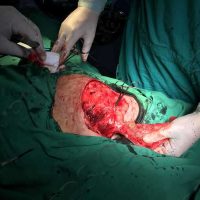
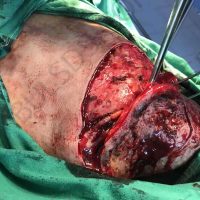
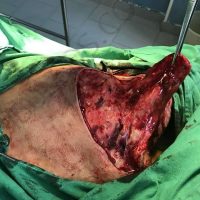
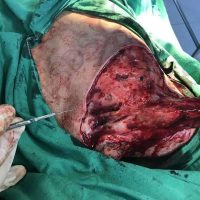
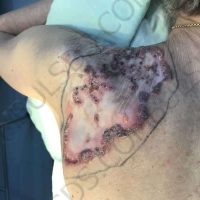
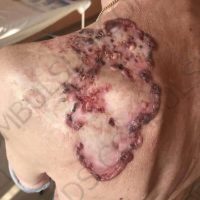
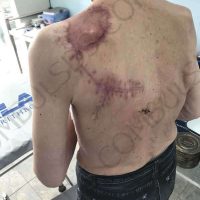
Информираме за пациент, който 3 години след прием на оригиналния продукт валсартан,(произведен от компанията Novartis в Германия, а не в Китай и вероятно без съдържание на NDMA), развива пигментна лезия в областта на горния крайник (2011 година). Медикаментите, които приема са Exforge 10/160mg от 2008г-. и Diovan 160mg от 2015г. до 10.2018г. Пациентът бе опериран преди няколко седмици и резултатите от хистологичното изследване са категорични, че става въпрос за малигнен меланом стадий IIB (T3bN0M0). Планирана е реексцизия с допълнително поле на оперативна сигурност, като паралелно с това отстраняване на дрениращ лимфен възел с оглед прецизиране на стадия и оптимиране на лечението.
Възможно е възникването на меланома и съпътстващата системна медикация с валсартан да са спорадична асоциация, но това би следвало да се провери. В абсолютно противоречие на този факт или асоциация са редица експериментални данни от 2018: те категорично сочат за възможния тригериращ потенциал на валсартана и лосартана по отношение развитието на меланоми или тяхното авансиране.
Важна публикация от тази година показва, че в проведените наскоро ин витро експерименти лосартанът би могъл да потенцира развититето и метастазирането на меланомите (Angiotensin II Type 1 Receptor Antagonist Losartan Affects NHE1-Dependent Melanoma Cell Behavior, Olschewski D et. al 2018.
Това означава или би било индиректна индикация, че канцерогенният ефект на валсартан като генерик не е свързан единствено с наличието или контаминацията с NDMA, а е възможно да идва директно от генеричната, оригиналната субстанция (независимо от производителя, в случая- немски). Нашите ин виво данни показват, че това може би е или би следвало да се разглежда като първия вероятен официализиран случай на развит меланом на кожата в рамките на системен прием на оригиналния генерик валсартан (в случая на фирмата Новартис). А не на базата на медикамента, контаминиран с NDMA! Дали немската продукция на валсартан е контамирана: към момента е неясно!?
Аналогично би следвало да бъде зададен въпросът защо различни авторски колективи от различни точки на света тестуват в експериментални условия влиянието на валсартан върху меланоцитите, невусите или меланомите? По всяка вероятност тези експерименти са били направени, за да се тестват определени клинични находки: в случая – пациенти с меланоми (вероятно)!
Поради тази причина ние – Българското дружество по дерматологична хирургия БДДХ/ Bulsds.com се свързахме с офиса на FDA и по техен съвет регистрирахме възможното канцерогенно действие (на валсартана на Новартис) на все още позволените на пазара медикаменти на Новартис в официалната им страница/платформа.
Друг интересен факт е, че Европейската агенция EMA (European Medicines Agency), сподели, че вече има 9 докладвани случаи на меланом при пациенти, приемащи медикамента валсартан. Интересното е, че те са базирани (най-вероятно) на приема на валсартан, контаминиран с NDMA? Друг интерес факт е, че тези случаи не са публично оповестени? Представяме официално първи ин виво данни на случай на пациент с прием на валсартан на фирмата Novartis, (произведен в Германия, който всъщност е все още на пазара и не попада в списъка на изтеглените продукти), който впоследствие развива меланом на кожата.
Споделената информация не е обвинителна към съответния производител- Новартис. Тя съдържа важни клинични наблюдения и анализи, които се подкрепят от последните експериментални данни в световната литература, както и от регистрираните до момента случаи на меланоми при пациенти с валсартан (данни, споделени от ЕМА)! При необходимост – данните са налични за преглед, анализ и дискусия.
Изложената на настоящия сайт информация не представлява по същността си потвърждение на причинно-следствена връзка между лекарствените продукти и констатираните ефекти. Информацията се отнася до подозирани и предполагаеми връзки, обусловени от наблюденията и мненията на медицинските лица, както и изразяват опасения за такива.
Гореизложените констатации се базират на законоопределеното задължение на заинтересованите лица за информиране на компетентните органи за подозирани сериозни нежелани лекарствени реакции, съгласно националното и европейското законодателство, свързано с проследяване на лекарствената безопасност.
Обръщаме внимание на посетителите на настоящия сайт, че не трябва да преустановяват приема на горепосочените лекарства по свое усмотрение, без да са се посъветвали с компетентно медицинско лице.
С уважение
Проф. д-р Г Чернев